

Die krimpkrag van enige eenheidslengte op die oppervlak van die vloeistof word die oppervlakspanning genoem, en die eenheid is N. · M-1.

Die eienskap van die vermindering van die oppervlakspanning van die oplosmiddel word oppervlakaktiwiteit genoem, en 'n stof met hierdie eienskap word 'n oppervlakaktiewe stof genoem.
Die oppervlakaktiewe stof wat molekules in waterige oplossing kan bind en micelle en ander assosiasies kan vorm, en 'n hoë oppervlakaktiwiteit het, terwyl dit ook die effek van benatting, emulgifisering, skuim, was, ens.
Surfaktant is organiese verbindings met spesiale struktuur en eiendom, wat die koppelvlakspanning tussen twee fases of die oppervlakspanning van vloeistowwe (oor die algemeen water) aansienlik kan verander, met benatting, skuim, emulgeer, was en ander eienskappe.
Wat struktuur betref, het oppervlakaktiewe middels 'n algemene kenmerk deurdat dit twee groepe verskillende aard in hul molekules bevat. Aan die een kant is 'n lang ketting van nie-polêre groep, oplosbaar in olie en onoplosbaar in water, ook bekend as hidrofobiese groep of waterafstotende groep. Sulke waterafstotende groep is oor die algemeen lang kettings van koolwaterstowwe, soms ook vir organiese fluoor, silikon, organofosfaat, organotienketting, ens. Aan die ander kant is wateroplosbare groep, 'n hidrofiliese groep of olie-afstotende groep. Die hidrofiliese groep moet voldoende hidrofilies wees om te verseker dat hele oppervlakaktiewe middels oplosbaar is in water en die nodige oplosbaarheid het. Aangesien oppervlakaktiewe middels hidrofiliese en hidrofobiese groepe bevat, kan dit oplosbaar wees in ten minste een van die vloeibare fases. Hierdie hidrofiliese en lipofiele eienskap van oppervlakaktiewe middel word amfifilisiteit genoem.


Surfaktant is 'n soort amfifiele molekules met beide hidrofobiese en hidrofiliese groepe. Hidrofobiese groepe oppervlakaktiewe middels bestaan meestal uit langketting koolwaterstowwe, soos reguit-ketting alkiel C8 ~ C20, vertakte ketting alkiel C8 ~ C20 , alkielfeniel (alkielkoolstoftomnommer is 8 ~ 16) en dergelike. Die verskil tussen hidrofobiese groepe is hoofsaaklik in die strukturele veranderinge van koolwaterstofkettings. En die soorte hidrofiliese groepe is meer, dus hou die eienskappe van oppervlakaktiewe middels hoofsaaklik verband met hidrofiliese groepe, benewens die grootte en vorm van hidrofobiese groepe. Die strukturele veranderinge van hidrofiliese groepe is groter as dié van hidrofobiese groepe, dus is die klassifikasie van oppervlakaktiewe middels gebaseer op die struktuur van hidrofiliese groepe. Hierdie klassifikasie is gebaseer op die vraag of die hidrofiliese groep ionies is of nie, en dit is verdeel in anioniese, kationiese, nie -ioniese, zwitterioniese en ander spesiale soorte oppervlakaktiewe middels.

① Adsorpsie van oppervlakaktiewe middels by die Interfac
Surfaktiewe molekules is amfifiele molekules met beide lipofiele en hidrofiliese groepe. As die oppervlakaktiewe middel in water opgelos word, word sy hidrofiliese groep aangetrokke tot water en los dit in water op, terwyl die lipofiele groep deur water afgestoot word en water laat, wat lei tot die adsorpsie van die oppervlakte -molekules (of ione) op die koppelvlak van die twee fases, wat die interfasiale tensie tussen die twee fases verminder. Hoe meer oppervlakaktiewe molekules (of ione) by die koppelvlak geadsorbeer word, hoe groter is die vermindering in koppelvlakspanning.
② Sommige eienskappe van adsorpsie membraan
Oppervlakdruk van die adsorpsie-membraan: Surfaktant-adsorpsie by die gas-vloeistof-koppelvlak om 'n adsorpsie-membraan te vorm, soos om 'n wrywinglose verwyderbare drywende plaat op die koppelvlak te plaas, die drywende vel druk die adsorberende membraan langs die oplossingsoppervlak, en die membraan genereer 'n druk op die drywende plaat, wat die oppervlakdruk genoem word.
Oppervlakviskositeit: Soos oppervlakdruk, is die viskositeit van die oppervlak 'n eienskap wat deur onoplosbare molekulêre membraan vertoon word. Opgehang deur 'n fyn metaaldraad -platinumring, sodat die vlak die wateroppervlak van die tenk kontak, draai die platinumring, die platinumring deur die viskositeit van die waterhindernis, die amplitude verval geleidelik, waarvolgens die viskositeit van die oppervlak gemeet kan word. Die metode is: Eerstens word die eksperiment op die suiwer wateroppervlak uitgevoer om die amplitude -verval te meet, en dan word die verval na die vorming van die oppervlakmembraan gemeet, en die viskositeit van die oppervlakmembraan word afgelei van die verskil tussen die twee.
Die viskositeit van die oppervlak hou nou verband met die soliditeit van die oppervlakmembraan, en aangesien die adsorpsie -membraan oppervlakdruk en viskositeit het, moet dit elastisiteit hê. Hoe hoër die oppervlakdruk en hoe hoër die viskositeit van die geadsorbeerde membraan, hoe hoër is die elastiese modulus. Die elastiese modulus van die oppervlakadsorpsie -membraan is belangrik in die proses van borrelstabilisering.
③ Vorming van micelle
Verdunde oplossings van oppervlakaktiewe middels gehoorsaam die wette wat deur ideale oplossings gevolg word. Die hoeveelheid oppervlakaktiewe middel wat op die oppervlak van die oplossing geadsorbeer word, neem toe met die konsentrasie van die oplossing, en as die konsentrasie 'n sekere waarde bereik of oorskry, neem die hoeveelheid adsorpsie nie meer toe nie, en hierdie oortollige oppervlakaktiewe molekules is op 'n lukraak manier of op 'n gereelde manier. Beide praktyk en teorie toon dat hulle assosiasies in oplossing vorm, en dat hierdie assosiasies micelle genoem word.
Kritiese micelle -konsentrasie (CMC): Die minimum konsentrasie waarteen oppervlakaktiewe middels micelle in die oplossing vorm, word die kritieke micelle -konsentrasie genoem.
④ CMC -waardes van gewone oppervlakaktiewe middels.

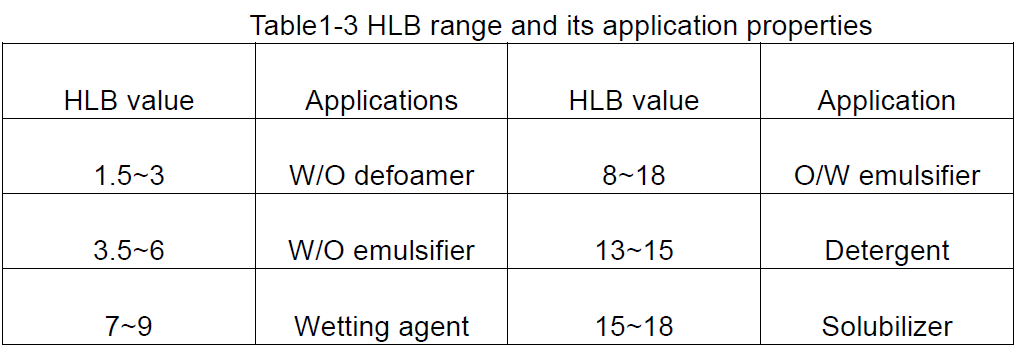
HLB is die afkorting van hidrofiele lipofiele balans, wat die hidrofiliese en lipofiele balans van die hidrofiliese en lipofiele groepe van die oppervlakaktiewe middel, dit wil sê die HLB -waarde van die oppervlakaktiewe middel aandui. 'N Groot HLB -waarde dui op 'n molekule met 'n sterk hidrofilisiteit en swak lipofilisiteit; Omgekeerd, sterk lipofilisiteit en swak hidrofilisiteit.
① Bepalings van HLB -waarde
Die HLB-waarde is 'n relatiewe waarde, dus as die HLB-waarde ontwikkel word, word die HLB-waarde van paraffienwas, wat geen hidrofiliese eienskappe het nie, 0, terwyl die HLB-waarde van natriumdodecylsulfaat, wat meer wateroplosbaar is, 40 is. HLB -waardes minder as 10 is lipofiel, terwyl dié groter as 10 hidrofilies is. Dus is die keerpunt van lipofiele tot hidrofilies ongeveer 10.
Op grond van die HLB-waardes van oppervlakaktiewe middels, kan 'n algemene idee van die moontlike gebruik daarvan verkry word, soos aangetoon in Tabel 1-3.

Twee wedersyds onoplosbare vloeistowwe, een wat in die ander versprei is, soos deeltjies (druppels of vloeibare kristalle) vorm 'n stelsel wat 'n emulsie genoem word. Hierdie stelsel is termodinamies onstabiel vanweë die toename in die grensarea van die twee vloeistowwe wanneer die emulsie gevorm word. Om die emulsie stabiel te maak, is dit nodig om 'n derde komponent by te voeg - emulgator om die koppelvlak -energie van die stelsel te verminder. Emulgator behoort tot die oppervlakaktiewe middel, die belangrikste funksie daarvan is om die rol van emulsie te speel. Die fase van die emulsie wat as druppels bestaan, word die verspreide fase (of die binneste fase, diskontinue fase) genoem, en die ander fase wat aan mekaar gekoppel is, word die verspreidingsmedium (of die buitenste fase, deurlopende fase) genoem.
① Emulgers en emulsies
Algemene emulsies, een fase is water of waterige oplossing, die ander fase is organiese stowwe wat nie met water, soos vet, was, ens, ontstaan nie. (water/olie). Komplekse water-in-olie-in-water w/o/w-tipe en olie-in-water-in-olie o/w/o-tipe multi-emulsies kan ook gevorm word.
Emulgers word gebruik om emulsies te stabiliseer deur die spanning van die koppelvlak te verminder en die vorm van enkelmolekule-koppelvlakmembraan te vorm.
In die emulgifikasie van die emulgator -vereistes:
A: Die emulgator moet die koppelvlak tussen die twee fases kan adsorbeer of verryk, sodat die koppelvlakspanning verminder word;
B: Die emulgator moet die deeltjies aan die lading gee, sodat elektrostatiese afstoting tussen die deeltjies, of 'n stabiele, hoogs viskose beskermende membraan rondom die deeltjies vorm.
Daarom moet die stof wat as emulgator gebruik word, amfifiele groepe hê om te emulgeer, en oppervlakaktiewe middels kan aan hierdie vereiste voldoen.
② Voorbereidingsmetodes van emulsies en faktore wat die stabiliteit van emulsies beïnvloed
Daar is twee maniere om emulsies voor te berei: een is om die meganiese metode te gebruik om die vloeistof in klein deeltjies in 'n ander vloeistof te versprei, wat meestal in die industrie gebruik word om emulsies voor te berei; Die ander is om die vloeistof in molekulêre toestand in 'n ander vloeistof op te los en dit dan behoorlik bymekaar te maak om emulsies te vorm.
Die stabiliteit van 'n emulsie is die vermoë tot aggregasie teen deeltjies wat tot faseskeiding lei. Emulsies is termodinamies onstabiele stelsels met groot vrye energie. Daarom is die sogenaamde stabiliteit van 'n emulsie eintlik die tyd wat nodig is vir die stelsel om ewewig te bereik, dit wil sê die tyd wat benodig word vir die skeiding van een van die vloeistowwe in die stelsel.
As die koppelvlakmembraan met vetterige alkohole, vetsure en vetterige amiene en ander polêre organiese molekules aansienlik hoër is. Dit is omdat in die koppelvlak -adsorpsielaag van emulgator -molekules en alkohole, sure en amiene en ander polêre molekules 'n 'kompleks' vorm, sodat die sterkte van die membraan van die koppelvlak toeneem.
Emulgers wat uit meer as twee oppervlakaktiewe middels bestaan, word gemengde emulgatoren genoem. Gemengde emulgator geadsorbeer by die water/olie -koppelvlak; Intermolekulêre werking kan komplekse vorm. As gevolg van die sterk intermolekulêre werking, word die koppelvlakspanning aansienlik verminder, en die hoeveelheid emulgator wat by die koppelvlak geadsorbeer word, word aansienlik verhoog, en die vorming van die membraandigtheid van die koppelvlak neem toe, neem die sterkte toe.
Die lading van die vloeibare krale het 'n beduidende uitwerking op die stabiliteit van die emulsie. Stabiele emulsies, waarvan die vloeibare krale oor die algemeen gelaai is. As 'n ioniese emulgator gebruik word, het die emulgatorioon wat by die koppelvlak geadsorbeer is, sy lipofiele groep in die oliefase geplaas en is die hidrofiliese groep in die waterfase, waardeur die vloeibare krale gelaai word. Aangesien die emulsie krale met dieselfde lading is, stoot hulle mekaar af, nie maklik om te vereer nie, sodat die stabiliteit verhoog word. Daar kan gesien word dat hoe meer emulgatorione op die krale geadsorbeer word, hoe groter is die lading, hoe groter is die vermoë om te voorkom dat die krale van agglomerasie, hoe stabieler die emulsie -stelsel.
Die viskositeit van die emulsieverspreidingsmedium het 'n sekere invloed op die stabiliteit van die emulsie. Oor die algemeen, hoe hoër die viskositeit van die verspreidingsmedium, hoe hoër is die stabiliteit van die emulsie. Dit is omdat die viskositeit van die verspreidingsmedium groot is, wat 'n sterk uitwerking op die Brownse beweging van die vloeibare krale het en die botsing tussen die vloeibare krale vertraag, sodat die stelsel stabiel bly. Gewoonlik kan die polimeerstowwe wat in emulsies opgelos kan word, die viskositeit van die stelsel verhoog en die stabiliteit van emulsies hoër maak. Daarbenewens kan polimere ook 'n sterk koppelvlakmembraan vorm, wat die emulsie -stelsel meer stabiel maak.
In sommige gevalle kan die toevoeging van soliede poeier ook die emulsie laat stabiliseer. Soliede poeier is in die water, olie of koppelvlak, afhangende van die olie, water op die benattingskapasiteit van die soliede poeier, as die soliede poeier nie heeltemal nat is met water nie, maar ook nat met olie, sal dit op die water en olie -koppelvlak bly.
Die soliede poeier maak die emulsie nie stabiel nie, want die poeier wat by die koppelvlak versamel word, verhoog die koppelvlakmembraan, wat soortgelyk is aan die koppelvlak -adsorpsie van emulgatormolekules, dus hoe nouer is die soliede poeiermateriaal by die koppelvlak gerangskik, hoe stabiel is die emulsie.
Surfaktante het die vermoë om die oplosbaarheid van onoplosbare of effens wateroplosbare organiese stowwe aansienlik te verhoog nadat hulle micelle in waterige oplossing gevorm het, en die oplossing is tans deursigtig. Hierdie effek van die micelle word oplosbaar genoem. Die oppervlakaktiewe middel wat oplosbare oplosmiddel kan veroorsaak, word oplosbaar genoem, en die organiese materiaal wat opgelos word, word oplosbare materiaal genoem.

Skuim speel 'n belangrike rol in die wasproses. Skuim is 'n verspreidingstelsel waarin 'n gas in 'n vloeistof of vaste stof versprei word, met die gas as die verspreide fase en die vloeistof of vaste stof as die verspreidingsmedium, waarvan eersgenoemde vloeibare skuim genoem word, terwyl laasgenoemde soliede skuim genoem word, soos skuim plastiek, skuimende glas, skuimende sement ens.
(1) Skuimvorming
Met skuim bedoel ons hier 'n totale lugborrels wat deur 'n vloeibare membraan geskei is. Hierdie tipe borrel styg altyd vinnig na die vloeibare oppervlak as gevolg van die groot verskil in digtheid tussen die verspreide fase (gas) en die verspreidingsmedium (vloeistof), gekombineer met die lae viskositeit van die vloeistof.
Die proses om 'n borrel te vorm, is om 'n groot hoeveelheid gas in die vloeistof te bring, en die borrels in die vloeistof keer vinnig terug na die oppervlak, en vorm 'n totale borrels wat deur 'n klein hoeveelheid vloeibare gas geskei word.
Skuim het twee belangrike eienskappe in terme van morfologie: een is dat die borrels as 'n verspreide fase dikwels veelvuldig in vorm is, dit is omdat die borrels by die kruising van die borrels 'n neiging is dat die vloeibare film tot 'n sekere mate belemmer word; Die tweede is dat suiwer vloeistowwe nie stabiele skuim kan vorm nie; die vloeistof wat skuim kan vorm, is ten minste twee of meer komponente. Waterkleurige oplossings van oppervlakaktiewe middels is tipies van stelsels wat geneig is tot skuimgenerering, en hul vermoë om skuim te genereer hou ook verband met ander eienskappe.
Surfaktante met goeie skuimkrag word skuimmiddels genoem. Alhoewel die skuimmiddel 'n goeie skuimvermoë het, maar die gevormde skuim kan moontlik nie 'n lang tyd onderhou nie, dit wil sê die stabiliteit daarvan is nie noodwendig goed nie. Ten einde die stabiliteit van die skuim te handhaaf, dikwels in die skuimmiddel om stowwe by te voeg wat die stabiliteit van die skuim kan verhoog, word die stof skuimstabilisator genoem, algemeen gebruikte stabilisator is lauryl -diethanolamien en dodecyl -dimetielamienoksied.
(2) Stabiliteit van die skuim
Skuim is 'n termodinamies onstabiele stelsel en die finale neiging is dat die totale oppervlakte van die vloeistof binne die stelsel afneem nadat die borrel gebreek is en die vrye energie afneem. Die lasterproses is die proses waardeur die vloeibare membraan wat die gas skei dikker en dunner word totdat dit breek. Daarom word die mate van stabiliteit van die skuim hoofsaaklik bepaal deur die snelheid van vloeistofafvoer en die sterkte van die vloeibare film. Die volgende faktore beïnvloed dit ook.
(3) Skuimvernietiging
Die basiese beginsel van skuimvernietiging is om die voorwaardes wat die skuim produseer of om die stabiliserende faktore van die skuim uit te skakel, te verander, en daar is dus fisiese en chemiese metodes om te laster.
Fisiese laster beteken om die toestande van skuimproduksie te verander, terwyl die chemiese samestelling van die skuimoplossing gehandhaaf word, soos eksterne versteurings, veranderinge in temperatuur of druk en ultrasoniese behandeling, alles effektiewe fisiese metodes is om skuim uit te skakel.
Die chemiese lastermetode is om sekere stowwe by te voeg om met die skuimmiddel in wisselwerking te wees om die sterkte van die vloeibare film in die skuim te verminder en sodoende die stabiliteit van die skuim te verminder om die doel van laster te bereik, word sulke stowwe misdadigers genoem. Die meeste van die laster is oppervlakaktiewe middels. Volgens die meganisme van laster moet DeFoamer dus 'n sterk vermoë hê om oppervlakspanning te verminder, maklik om op die oppervlak te adsorbeer, en die interaksie tussen die oppervlakadsorpsiemolekules is swak, adsorpsiemolekules wat in 'n meer los struktuur gerangskik is.
Daar is verskillende soorte defoamer, maar basies is dit almal nie-ioniese oppervlakaktiewe middels. Nie-ioniese oppervlakaktiewe middels het eienskappe teen skuimende eienskappe naby of bo hul wolkpunt en word dikwels as laster gebruik. Alkohols, veral alkohole met 'n vertakkende struktuur, vetsure en vetsuuresters, polyamides, fosfaatesters, silikoonolies, ens. Word ook gereeld as uitstekende laster gebruik.
(4) Skuim en was
Daar is geen direkte verband tussen skuim en die effektiwiteit van die was nie, en die hoeveelheid skuim dui nie op die effektiwiteit van die was nie. Nie -ioniese oppervlakaktiewe middels het byvoorbeeld baie minder skuimende eienskappe as seep, maar hul ontsmettings is baie beter as seep.
In sommige gevalle kan skuim nuttig wees om vuil en vuil te verwyder. Byvoorbeeld, as u skottelgoed in die huis was, tel die skuim van die skoonmaakmiddel die oliedruppels op, en as u matte skrop, help die skuim om stof, poeier en ander soliede vuil op te tel. Daarbenewens kan skuim soms gebruik word as 'n aanduiding van die effektiwiteit van 'n skoonmaakmiddel. Aangesien vetterige olies 'n inhiberende effek op die skuim van die skoonmaakmiddel het, sal daar te veel olie en te min skoonmaakmiddel veroorsaak word, of die oorspronklike skuim sal verdwyn. Skuim kan ook soms gebruik word as 'n aanduiding van die netheid van 'n spoel, aangesien die hoeveelheid skuim in die spoeloplossing geneig is om af te neem met die vermindering van skoonmaakmiddel, sodat die hoeveelheid skuim gebruik kan word om die mate van spoeling te evalueer.
In 'n breë sin is wasgoed die proses om ongewenste komponente uit die voorwerp te verwyder en 'n doel te bereik. Was in die gewone sin verwys na die proses om vuil van die draer se oppervlak te verwyder. By die was word die interaksie tussen die vuil en die draer verswak of uitgeskakel deur die werking van sommige chemiese stowwe (bv. Doodgent, ens.), Sodat die kombinasie van vuil en draer in die kombinasie van vuil en skoonmaakmiddel verander word, en uiteindelik word die vuil van die draer geskei. Aangesien die voorwerpe wat gewas moet word en die vuil wat verwyder moet word, uiteenlopend is, is was 'n baie ingewikkelde proses en die basiese wasproses kan in die volgende eenvoudige verhoudings uitgedruk word.
Carrie ·· vuil + skoonmaakmiddel = draer + vuil · skoonmaakmiddel
Die wasproses kan gewoonlik in twee fases verdeel word: eerstens, onder die werking van die skoonmaakmiddel, word die vuil van sy draer geskei; Tweedens word die losstaande vuil versprei en in die medium opgeskort. Die wasproses is 'n omkeerbare proses en die vuil wat in die medium versprei en opgeskort word, kan ook van die medium na die voorwerp gewas word. Daarom moet 'n goeie skoonmaakmiddel die vermoë hê om vuilheid te versprei en op te hang en die herposissie van vuil te voorkom, benewens die vermoë om vuil van die draer te verwyder.
(1) Tipes vuil
Selfs vir dieselfde item kan die tipe, samestelling en hoeveelheid vuil wissel afhangende van die omgewing waarin dit gebruik word. Vuil van olie -liggaam is hoofsaaklik sommige diere- en plantaardige olies en minerale olies (soos ru -olie, brandstofolie, steenkoolte -teer, ens.), Soliede vuil is hoofsaaklik roet, as, roes, koolstof swart, ens. Wat die grond van klere betref, is daar vuil van die menslike liggaam, soos sweet, seebum, bloed, ens.; vuilgoed van voedsel, soos vrugtevlekke, kookolie -vlekke, kruidvlekke, stysel, ens.; vuil van skoonheidsmiddels, soos lipstiffie, naellak, ens.; vuil uit die atmosfeer, soos roet, stof, modder, ens.; ander, soos ink, tee, deklaag, ens. Dit kom in verskillende soorte.
Die verskillende soorte vuil kan gewoonlik in drie hoofkategorieë verdeel word: soliede vuil, vloeibare vuil en spesiale vuil.
① Soliede vuil
Gewone soliede vuil bevat deeltjies van as, modder, aarde, roes en koolstof swart. Die meeste van hierdie deeltjies het 'n elektriese lading op hul oppervlak, die meeste daarvan is negatief gelaai en kan maklik op veselitems geadsorbeer word. Soliede vuil is oor die algemeen moeilik om in water op te los, maar kan deur skoonmaakmiddeloplossings versprei en opgeskort word. Soliede vuil met 'n kleiner massapunt is moeiliker om te verwyder.
② Vloeistof vuil
Vloeistofvuil is meestal olie-oplosbaar, insluitend plant- en dierolie, vetsure, vetterige alkohole, minerale olies en hul oksiede. Onder hulle kan plant- en dierlike olies, vetsure en alkali -saponifisering voorkom, terwyl vetterige alkohole, minerale olies nie deur alkali gesaponifiseer word nie, maar dit kan oplosbaar wees in alkohole, eters en organiese oplosmiddels vir koolwaterstof, en emulsifisering van die wateroplossing en verspreiding. Olieoplosbare vloeibare vuil het oor die algemeen 'n sterk krag met veselitems, en is stewiger geadsorbeer op vesels.
③ Spesiale vuil
Spesiale vuilgoed bevat proteïene, stysel, bloed, menslike afskeidings soos sweet, sebum, urine en vrugtesap en teesap. Die meeste van hierdie tipe vuil kan chemies en sterk geadsorbeer word op veselitems. Daarom is dit moeilik om te was.
Die verskillende soorte vuil word selde alleen aangetref, maar word dikwels gemeng en op die voorwerp geadsorbeer. Vuil kan soms onder eksterne invloede geoksideer, ontbind of verval word, en sodoende nuwe vuilheid skep.
(2) Die hegting van vuil
Klere, hande, ens. Kan gevlek word omdat daar 'n soort interaksie tussen die voorwerp en die vuil is. Vuil voldoen aan voorwerpe op verskillende maniere, maar daar is nie meer as fisiese en chemiese hechtings nie.
① Die hegting van roet, stof, modder, sand en houtskool aan klere is 'n fisiese hegting. Oor die algemeen is die rol tussen die bevlekte voorwerp relatief swak deur hierdie hegting van vuil, en die rol tussen die bevlekte voorwerp is ook relatief maklik. Volgens die verskillende kragte kan die fisiese hegting van vuil in meganiese hegting en elektrostatiese hegting verdeel word.
A: Meganiese hegting
Hierdie tipe hegting verwys hoofsaaklik na die hegting van 'n mate van soliede vuil (bv. Stof, modder en sand). Meganiese hegting is een van die swakker vorme van hegting van vuil en kan byna op slegs meganiese middele verwyder word, maar as die vuil klein is (<0.1um), is dit moeiliker om te verwyder.
B : Elektrostatiese hegting
Elektrostatiese hechting word hoofsaaklik gemanifesteer in die werking van gelaaide vuil deeltjies op teenoorgestelde gelaaide voorwerpe. Die meeste veselagtige voorwerpe word negatief in water gelaai en kan maklik deur sekere positief gelaaide vuil, soos kalksoorte, aangeheg word. Sommige vuil, hoewel negatief gelaai, soos koolstof swart deeltjies in waterige oplossings, kan vesels deur ioniese brûe (ione tussen veelvuldige teenoorgestelde gelaaide voorwerpe, saamwerk, saam met hulle op 'n brugagtige manier optree) wat gevorm word deur positiewe ione in water (bv, Ca2+ , mg2+ ens.).
Elektrostatiese werking is sterker as eenvoudige meganiese werking, wat die verwydering van vuil relatief moeilik maak.
② Chemiese hegting
Chemiese hegting verwys na die verskynsel van vuil wat op 'n voorwerp werk deur middel van chemiese of waterstofbindings. Byvoorbeeld, polêre soliede vuil, proteïen, roes en ander hegting op veselitems, vesels bevat karboksiel, hidroksiel, amied en ander groepe, hierdie groepe en olierige vuil vetsure, vetterige alkohole is maklik om waterstofbindings te vorm. Die chemiese kragte is oor die algemeen sterk en die vuil is dus stewiger aan die voorwerp gebind. Hierdie tipe vuil is moeilik om volgens die gewone metodes te verwyder en benodig spesiale metodes om dit te hanteer.
Die mate van hegting van vuil hou verband met die aard van die vuil self en die aard van die voorwerp waaraan dit voldoen. Oor die algemeen kleef deeltjies maklik aan veselagtige items. Hoe kleiner die tekstuur van die soliede vuil, hoe sterker is die hegting. Polêre vuil op hidrofiliese voorwerpe soos katoen en glas kleef sterker as nie-polêre vuil. Nie-polêre vuil kleef sterker as polêre vuil, soos poolvette, stof en klei, en is minder maklik om te verwyder en skoon te maak.
(3) Vuilverwyderingsmeganisme
Die doel van was is om vuil te verwyder. In 'n medium van 'n sekere temperatuur (hoofsaaklik water). Die gebruik van die verskillende fisiese en chemiese effekte van die skoonmaakmiddel om die effek van vuil en gewasde voorwerpe te verswak of uit te skakel, onder die werking van sekere meganiese kragte (soos handvryf, opwinding van die wasmasjien, die impak van die water), sodat die vuil en gewaste voorwerpe van die doel van dekontaminasie.
① Meganisme van vloeibare vuil verwydering
A : Benatting
Vloeistoftoevoer is meestal olie-gebaseer. Olievlekke nat is die meeste veselagtige voorwerpe en versprei min of meer as 'n oliefilm op die oppervlak van die veselagtige materiaal. Die eerste stap in die wasaksie is die benatting van die oppervlak deur die wasvloeistof. Ter illustrasie kan die oppervlak van 'n vesel beskou word as 'n gladde, soliede oppervlak.
B: Olie -losmaking - Krulmeganisme
Die tweede stap in die wasaksie is die verwydering van olie en vet, die verwydering van vloeibare vuil word bewerkstellig deur 'n soort spoel. Die vloeibare vuil het oorspronklik op die oppervlak in die vorm van 'n verspreide oliefilm bestaan, en onder die voorkeur -benattingseffek van die wasvloeistof op die soliede oppervlak (dit wil sê die veseloppervlak), het dit stap vir stap in oliekrale opgekrul, wat deur die wasvloeistof vervang is en uiteindelik die oppervlak onder sekere eksterne kragte gelaat het.
② Meganisme van soliede vuil verwydering
Die verwydering van vloeibare vuil is hoofsaaklik deur die voorkeurbenatting van die vuil draer deur die wasoplossing, terwyl die verwyderingsmeganisme vir soliede vuil anders is, waar die wasproses hoofsaaklik handel oor die benatting van die vuilmassa en die draeroppervlak deur die wasoplossing. As gevolg van die adsorpsie van oppervlakaktiewe middels op die soliede vuil en die draeroppervlak daarvan, word die interaksie tussen die vuil en die oppervlak verminder en word die hegtingssterkte van die vuilmassa op die oppervlak verminder, dus word die vuilmassa maklik van die oppervlak van die draer verwyder.
Daarbenewens het die adsorpsie van oppervlakaktiewe middels, veral ioniese benattingsmiddels, op die oppervlak van die vaste vuilheid en die draer daarvan die potensiaal om die oppervlakpotensiaal op die oppervlak van die soliede vuil en sy draer te verhoog, wat meer bevorderlik is vir die verwydering van die vuil. Vaste of oor die algemeen is veselagtige oppervlaktes gewoonlik negatief gelaai in waterige media en kan daarom diffuse dubbele elektroniese lae op vuilmassas of soliede oppervlaktes vorm. As gevolg van die afstoting van homogene ladings, word die hegting van vuil deeltjies in die water na die soliede oppervlak verswak. As 'n anioniese oppervlakaktiewe middel bygevoeg word, omdat dit terselfdertyd die negatiewe oppervlakpotensiaal van die vuil deeltjie en die soliede oppervlak kan verhoog, word die afstoting tussen hulle meer verbeter, die hegtingssterkte van die deeltjie word meer verminder, en die vuil is makliker om te verwyder.
Nie-ioniese oppervlakaktiewe middels word geadsorbeer op die algemeen gelaaide soliede oppervlaktes, en hoewel dit nie die koppelvlakpotensiaal noemenswaardig verander nie, is die geadsorbeerde nie-ioniese benattingsmiddels geneig om 'n sekere dikte geadsorbeerde laag op die oppervlak te vorm wat help om die herposisionering van vuil te voorkom.
In die geval van kationiese oppervlakaktiewe middels, verminder of elimineer hul adsorpsie die negatiewe oppervlakpotensiaal van die vuilmassa en die draeroppervlak, wat die afstoting tussen die vuil en die oppervlak verminder en dus nie bevorderlik is vir die verwydering van vuil nie; Verder, na adsorpsie op die soliede oppervlak, is kationiese oppervlakaktiewe middels geneig om die soliede oppervlak hidrofobies te maak en is dit dus nie bevorderlik vir die benatting van die oppervlak en dus was nie.
③ Die verwydering van spesiale gronde
Proteïne, stysel, menslike afskeidings, vrugtesap, teesap en ander sulke vuil is moeilik om met normale oppervlakaktiewe middels te verwyder en benodig spesiale behandeling.
Proteïenvlekke soos room, eiers, bloed, melk en veluitskeiding is geneig om op die vesels en degenerasie te koaguleer en sterker hegting te kry. Proteïne -soiling kan verwyder word deur proteases te gebruik. Die ensiemprotease breek die proteïene in die vuil af in wateroplosbare aminosure of oligopeptiede.
Styselvlekke kom hoofsaaklik van voedsel, ander soos sous, gom, ens. Amylase het 'n katalitiese effek op die hidrolise van styselvlekke, wat veroorsaak dat stysel in suikers afbreek.
Lipase kataliseer die ontbinding van trigliseriede, wat moeilik is om volgens normale metodes, soos sebum en eetbare olies, te verwyder en dit in oplosbare gliserol en vetsure af te breek.
Sommige gekleurde vlekke van vrugtesap, teesap, ink, lipstiffie, ens. Is dikwels moeilik om deeglik skoon te maak, selfs na herhaalde was. Hierdie vlekke kan verwyder word deur 'n redoksreaksie met 'n oksiderende of reduseermiddel soos bleikmiddel, wat die struktuur van die kleurgenererende of kleur-luksiliêre groepe vernietig en dit in kleiner wateroplosbare komponente degradeer.
(4) Vlekverwyderingsmeganisme van droogskoonmaak
Bogenoemde is eintlik vir water as die wasmiddel. In werklikheid, as gevolg van die verskillende soorte klere en struktuur, is sommige klere wat waterwas gebruik, nie gerieflik of nie maklik om skoon te was nie, 'n bietjie klere na was en selfs vervorming, vervaag, ens., Byvoorbeeld: die meeste natuurlike vesels absorbeer water en maklik om te swel, en droog en maklik om te krimp, sodat dit vervorm sal word; Deur wolprodukte te was, lyk dit ook dikwels in die krimpverskynsel, en sommige wolprodukte met waterwas is ook maklik om te pil, kleurverandering; Sommige sye wat met die hand gevoel word, word erger na was en verloor hul glans. Vir hierdie klere gebruik dit dikwels die droë skoonmaakmetode om te ontsmet. Die sogenaamde droogskoonmaak verwys gewoonlik na die wasmetode in organiese oplosmiddels, veral in nie-polêre oplosmiddels.
Droë skoonmaak is 'n sagter vorm van wasgoed as waterwas. Aangesien droogskoonmaak nie veel meganiese werking benodig nie, veroorsaak dit nie skade, rimpeling en vervorming van klere nie, terwyl droë skoonmaakmiddels, in teenstelling met water, selde uitbreiding en sametrekking lewer. Solank die tegnologie behoorlik hanteer word, kan die klere droog skoongemaak word sonder verdraaiing, vervaag van kleur en verlengde lewensduur.
Wat droë skoonmaak betref, is daar drie breë soorte vuil.
①olie-oplosbare vuil olieoplosbare vuil bevat allerhande olie en vet, wat vloeibaar of vetterig is en opgelos kan word in droogskoonmaakmiddels.
② Water-oplosbare vuil wateroplosbare vuil is oplosbaar in waterige oplossings, maar nie in droë skoonmaakmiddels nie, word in 'n waterige toestand geadsorbeer, water verdamp na die neerslag van korrelvaste stowwe, soos anorganiese soute, stysel, proteïne, ens.
③Oil en water onoplosbare vuil olie en water onoplosbare vuil is nie oplosbaar in water nie en ook nie oplosbaar in droë skoonmaakmiddels nie, soos koolstof swart, silikate van verskillende metale en oksiede, ens.
Vanweë die verskillende aard van verskillende soorte vuil, is daar verskillende maniere om vuil in die droogskoonmaakproses te verwyder. Olieoplosbare gronde, soos diere- en plantaardige olies, minerale olies en ghries, is maklik oplosbaar in organiese oplosmiddels en kan makliker verwyder word in droogskoonmaak. Die uitstekende oplosbaarheid van droë-skoonmaakmiddels vir olies en vette kom in wese van die Van der Walls-kragte tussen molekules.
Vir die verwydering van wateroplosbare vuil soos anorganiese soute, suikers, proteïene en sweet, moet die regte hoeveelheid water ook by die droë skoonmaakmiddel gevoeg word, anders is dit moeilik om wateroplosbare vuil uit die klere te verwyder. Water is egter moeilik om op te los in die droë skoonmaakmiddel, dus om die hoeveelheid water te verhoog, moet u ook oppervlakaktiewe middels byvoeg. Die teenwoordigheid van water in die droë skoonmaakmiddel kan die oppervlak van die vuil en klere gehidreer maak, sodat dit maklik is om met die polêre groepe oppervlakaktiewe middels te kommunikeer, wat bevorderlik is vir die adsorpsie van oppervlakaktiewe middels op die oppervlak. Boonop, wanneer oppervlakaktiewe stowwe micelle vorm, kan wateroplosbare vuil en water in die micelle oplosbaar word. Benewens die verhoging van die waterinhoud van die droë skoonmaakmiddel, kan oppervlakaktiewe middels ook 'n rol speel in die voorkoming van die herafsetting van vuil om die ontsmettingseffek te verbeter.
Die teenwoordigheid van 'n klein hoeveelheid water is nodig om wateroplosbare vuil te verwyder, maar te veel water kan vervorming en rimpeling in sommige klere veroorsaak, dus moet die hoeveelheid water in die droë skoonmaakmiddel matig wees.
Vuil wat nie wateroplosbaar of olie-oplosbaar is nie, soliede deeltjies soos as, modder, aarde en koolstof swart, word meestal aan die kledingstuk vasgemaak deur elektrostatiese kragte of in kombinasie met olie. In droë skoonmaak, die vloei van oplosmiddel, kan die impak die elektrostatiese kragadsorpsie van vuil af maak, en 'n droë skoonmaakmiddel kan die olie oplos, sodat die kombinasie van olie en vuil en vasgemaak aan die klere van vaste deeltjies in die droë skoonmaakmiddel, droë skoonmaakmiddel in 'n klein hoeveelheid water en surfaktante, sodat die vaste grondslag kan voorkom, dit kan voorkom, om die vaste grond te voorkom, dit kan voorkom dat dit die vaste grond is klere.
(5) Faktore wat wasaksie beïnvloed
Die rigting van adsorpsie van oppervlakaktiewe middels by die koppelvlak en die vermindering van die oppervlak (koppelvlak) spanning is die belangrikste faktore in die verwydering van vloeistof of soliede vuil. Die wasproses is egter ingewikkeld en die waseffek, selfs met dieselfde skoonmaakmiddeltipe, word deur baie ander faktore beïnvloed. Hierdie faktore sluit die konsentrasie van die skoonmaakmiddel, die temperatuur, die aard van die grond, die tipe vesel en die struktuur van die stof in.
① Surfaktantkonsentrasie
Die micelle van oppervlakaktiewe middels in oplossing speel 'n belangrike rol in die wasproses. As die konsentrasie die kritieke micelle -konsentrasie (CMC) bereik, neem die waseffek skerp toe. Daarom moet die konsentrasie van skoonmaakmiddel in die oplosmiddel hoër wees as die CMC -waarde om 'n goeie waseffek te hê. As die konsentrasie van oppervlakaktiewe middel egter hoër is as die CMC -waarde, is die inkrementele toename in die waseffek nie voor die hand liggend nie en is dit nie nodig om die konsentrasie van oppervlakaktiewe middels te verhoog nie.
By die verwydering van olie deur oplosbaarheid neem die oplosbare effek toe met toenemende konsentrasie van die oppervlakaktiewe middel, selfs as die konsentrasie bo CMC is. Op die oomblik is dit raadsaam om skoonmaakmiddel op 'n plaaslike gesentraliseerde manier te gebruik. Byvoorbeeld, as daar baie vuil op die boeie en 'n kledingstuk van 'n kledingstuk is, kan 'n laag skoonmaakmiddel tydens was toegedien word om die oplosbare effek van die oppervlakaktiewe middel op die olie te verhoog.
② Temperatuur het 'n baie belangrike invloed op die dekontaminasie -aksie. Oor die algemeen vergemaklik die verhoging van die temperatuur die verwydering van vuil, maar soms kan 'n te hoë temperatuur ook nadele veroorsaak.
Die toename in temperatuur vergemaklik die diffusie van vuil, soliede vet word maklik geëmulgeer by temperature bo sy smeltpunt en die vesels neem toe in swelling as gevolg van die toename in temperatuur, wat die verwydering van vuil vergemaklik. Vir kompakte materiaal word die mikrogapte tussen die vesels egter verminder namate die vesels uitbrei, wat nadelig is vir die verwydering van vuil.
Temperatuurveranderinge beïnvloed ook die oplosbaarheid, CMC -waarde en micelle -grootte van oppervlakaktiewe middels, wat die waseffek beïnvloed. Die oplosbaarheid van oppervlakaktiewe middels met lang koolstofkettings is laag by lae temperature en soms is die oplosbaarheid selfs laer as die CMC -waarde, dus moet die wastemperatuur toepaslik verhoog word. Die effek van temperatuur op die CMC-waarde en die micelle-grootte verskil van ioniese en nie-ioniese oppervlakaktiewe middels. Vir ioniese benattingsmiddels verhoog 'n toename in temperatuur gewoonlik die CMC -waarde en verminder dit die micelle -grootte, wat beteken dat die konsentrasie van oppervlakaktiewe middel in die wasoplossing verhoog moet word. Vir nie-ioniese oppervlakaktiewe middels lei 'n toename in temperatuur tot 'n afname in die CMC-waarde en 'n beduidende toename in micelle-volume, dus is dit duidelik dat 'n toepaslike toename in temperatuur die nie-ioniese oppervlakaktiewe middel sal help om die oppervlakaktiewe effek daarvan uit te oefen. Die temperatuur moet egter nie sy wolkpunt oorskry nie.
Kortom, die optimale wastemperatuur hang af van die formulering van die skoonmaakmiddel en die voorwerp wat gewas word. Sommige skoonmaakmiddels het 'n goeie skoonmaakmiddel -effek by kamertemperatuur, terwyl ander 'n baie ander skoonmaakmiddel het tussen koue en warm was.
③ Skuim
Dit is gebruiklik om skuimende krag met waseffek te verwar, en glo dat skoonmaakmiddels met 'n hoë skuimkrag 'n goeie waseffek het. Navorsing het getoon dat daar geen direkte verband bestaan tussen die waseffek en die hoeveelheid skuim nie. Byvoorbeeld, om met lae skuimende skoonmaakmiddels te was, is nie minder effektief as om met hoë skuimende skoonmaakmiddels te was nie.
Alhoewel skuim nie direk verband hou met wasgoed nie, is daar geleenthede wanneer dit help om vuil te verwyder, byvoorbeeld as u skottelgoed met die hand was. As u matte skrop, kan skuim ook stof en ander soliede vuil deeltjies wegneem, en die tapytvuil is verantwoordelik vir 'n groot deel van die stof, sodat die skoonmaakmiddels van die matte 'n sekere skuimvermoë moet hê.
Skuimkrag is ook belangrik vir sjampoe, waar die fyn skuim wat deur die vloeistof tydens sjampoe of bad geproduseer word, die hare gesmeer en gemaklik laat voel.
④ Variëteite van vesels en fisiese eienskappe van tekstiele
Benewens die chemiese struktuur van die vesels, wat die hegting en verwydering van vuil beïnvloed, het die voorkoms van die vesels en die organisasie van die garing en die stof 'n invloed op die gemak van vuil verwydering.
Die skaal van wolvesels en die geboë plat linte van katoenvesels is meer geneig om vuil op te bou as gladde vesels. Byvoorbeeld, koolstof swart gekleur op sellulose -films (viskose -films) is maklik om te verwyder, terwyl koolstof swart op katoenstowwe moeilik is om af te was. 'N Ander voorbeeld is dat kort veselstowwe wat van poliëster gemaak is, meer geneig is om olievlekke te versamel as materiaal met lang vesel, en olievlekke op kort veselstowwe is ook moeiliker om te verwyder as olievlekke op lang veselstowwe.
Styf gedraaide garings en stywe materiale, as gevolg van die klein gaping tussen die vesels, kan die inval van vuil weerstaan, maar dieselfde kan ook voorkom dat die wasvloeistof die interne vuil uitsluit, sodat stywe materiale vuil weerstaan, maar sodra die gewas was, is dit ook moeiliker.
⑤ Hardheid van water
Die konsentrasie van Ca2+, Mg2+ en ander metaalione in die water het 'n groot invloed op die waseffek, veral as die anioniese benattingsmiddels Ca2+ en Mg2+ -ione teëkom wat kalsium- en magnesiumsoute vorm wat minder oplosbaar is en die skoonmaaklikheid daarvan sal verminder. In harde water, selfs al is die konsentrasie van oppervlakaktiewe middel hoog, is die skoonmaaklikheid steeds baie erger as in distillasie. Vir die oppervlakaktiewe middel om die beste waseffek te hê, moet die konsentrasie van Ca2+ -ione in die water verminder word tot 1 x 10-6 mol/L (CACO3 tot 0,1 mg/L) of minder. Dit vereis die toevoeging van verskillende versagmiddels tot die skoonmaakmiddel.
Postyd: Februarie 25-2022



